



一、原子核外电子运动状况,了解电子云、电子层(能层)、原子轨迹(能级)的意义.
1.电子云:用小黑点的疏密来描绘电子在原子核外空间出现的时机巨细所得的图形叫电子云图.离核越近,电子出现的时机大,电子云密度越大;离核越远,电子出现的时机小,电子云密度越小.
电子层(能层):依据电子的能量差异和首要运动区域的不同,核外电子别离处于不同的电子层.原子由里向外对应的电子层符号别离为K、L、M、N、O、P、Q.
原子轨迹(能级即亚层):处于同一电子层的原子核外电子,也能够在不一样的原子轨迹上运动,别离用s、p、d、f表明不一样的形状的轨迹,s轨迹呈球形、p轨迹呈纺锤形,d轨迹和f轨迹较杂乱.各轨迹的扩展方向个数顺次为1、3、5、7.
了解多电子原子中核外电子分层排布遵从的原理,能用电子排布式表明1~36号元素原子核外电子的排布.
(1).原子核外电子的运动特征能够用电子层、原子轨迹(亚层)和自旋方历来进行描绘.在含有多个核外电子的原子中,不存在运动状况完全相同的两个电子.
③.洪特规矩:在能量相同的轨迹上排布时,电子尽可能分占不同的轨迹,且自旋状况相同.
②依据结构原理,能够将各能级按能量的差异分红能级组,由下而上表明七个能级组,其能量顺次升高;在同一能级组内,从左到右能量顺次升高。基态原子核外电子的排布按能量由低到高的次序顺次排布。
榜首电离能:气态电中性基态原子失掉1个电子,转化为气态基态正离子所需求的能量叫做榜首电离能。常用符号I1表明,单位为kJ/mol。
跟着原子序数的添加,元素原子的外围电子排布出现周期性的改变:每隔必定数意图元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性改变.
同周期从左到右,榜首电离能有逐步增大的趋势,稀有气体的榜首电离能最大,碱金属的榜首电离能最小;
①同周期元素,从左往右榜首电离能呈增大趋势。电子亚层结构为全满、半满时较相邻元素要大即第ⅡA族、第ⅤA族元素的榜首电离能别离大于同周期相邻元素。Be、N、Mg、P
b.用来比较元素的金属性的强弱.I1越小,金属性越强,表征原子失电子才能强弱.
跟着原子序数的递加,元素的电负性呈周期性改变:同周期从左到右,主族元素电负性逐步增大;同一主族从上到下,元素电负性出现减小的趋势.
a.确认元素类型(一般1.8,非金属元素;1.8,金属元素).
b.确认化学键类型(两元素电负性差值1.7,离子键;1.7,共价键).
d.电负性是判别金属性和非金属性强弱的重要参数(表征原子得电子才能强弱).
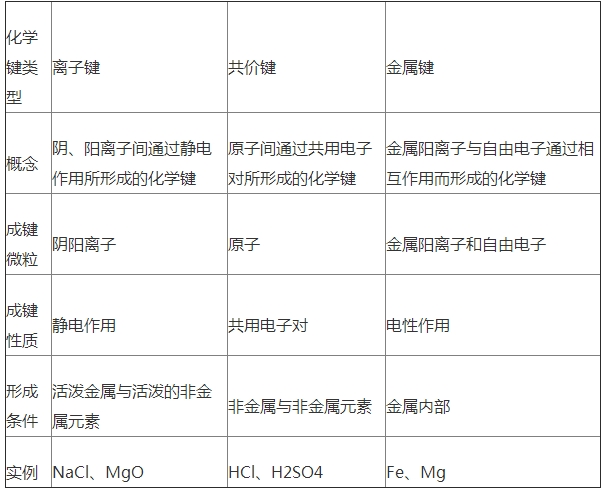
1.了解离子键的意义,能阐明离子键的构成.了解NaCl型和CsCl型离子晶体的结构特征,能用晶格能解说离子化合物的物理性质.
(1).化学键:相邻原子之间激烈的相互作用.化学键包含离子键、共价键和金属键.
离子键强弱的判别:离子半径越小,离子所带电荷越多,离子键越强,离子晶体的熔沸点越高.
离子键的强弱能够用晶格能的巨细来衡量,晶格能是指拆开1mol离子晶体使之构成气态阴离子和阳离子所吸收的能量.晶格能越大,离子晶体的熔点越高、硬度越大.
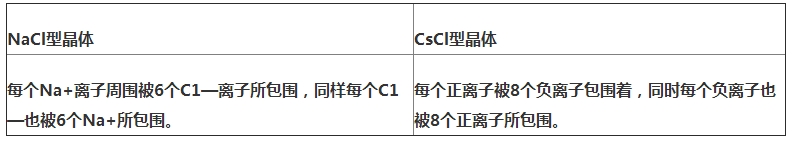
典型的离子晶体结构:NaCl型和CsCl型.氯化钠晶体中,每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,每个氯化钠晶胞中含有4个钠离子和4个氯离子;氯化铯晶体中,每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,每个氯化铯晶胞中含有1个铯离子和1个氯离子.
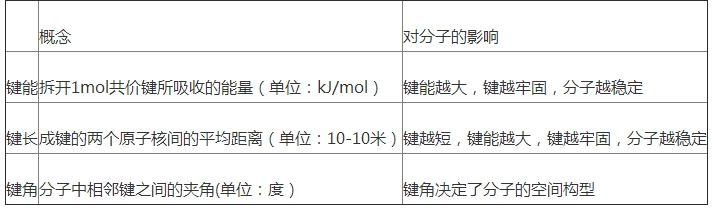
2.了解共价键的首要类型键和键,能用键能、键长、键角等数据阐明简略分子的某些性质(对键和键之间相对强弱的比较不作要求).
(1)共价键的分类和判别:键(“头碰头”堆叠)和键(“肩碰肩”堆叠)、极性键和非极性键,还有一类特别的共价键-配位键.

共价键的键能与化学反应热的联系:反应热=一切反应物键能总和-一切生成物键能总和.
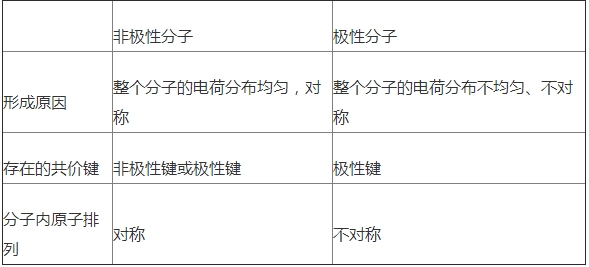
极性键:不同种原子之间构成的共价键,成键原子招引电子的才能不同,共用电子对产生偏移.
非极性键:同种原子之间构成的共价键,成键原子招引电子的才能相同,共用电子对不产生偏移.
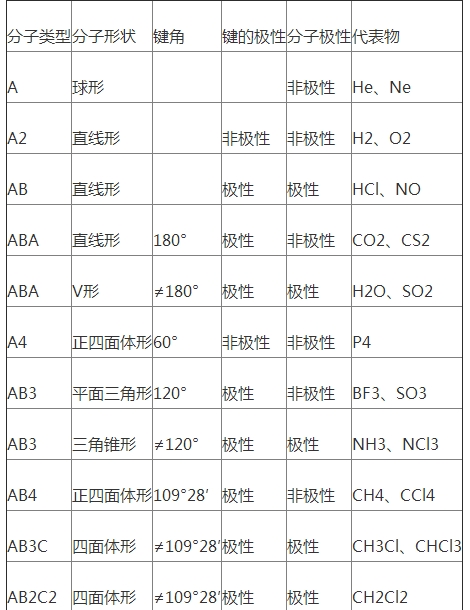
②分子极性的判别:分子的极性由共价键的极性及分子的空间构型两个方面一起决议.
了解原子晶体的特征,能描绘金刚石、二氧化硅等原子晶体的结构与性质的联系.
(1)原子晶体:一切原子间经过共价键结组成的晶体或相邻原子间以共价键相结合而构成空间立体网状结构的晶体.
(2)典型的原子晶体有金刚石(C)、晶体硅(Si)、二氧化硅(SiO2)
金刚石是正四面体的空间网状结构,最小的碳环中有6个碳原子,每个碳原子与周围四个碳原子构成四个共价键;晶体硅的结构与金刚石类似;二氧化硅晶体是空间网状结构,最小的环中有6个硅原子和6个氧原子,每个硅原子与4个氧原子成键,每个氧原子与2个硅原子成键.
(3)共价键强弱和原子晶体熔沸点巨细的判别:原子半径越小,构成共价键的键长越短,共价键的键能越大,其晶体熔沸点越高.如熔点:金刚石碳化硅晶体硅.
6.了解金属键的意义,能用金属键的自由电子理论解说金属的一些物理性质.知道金属晶体的根本堆积方法,了解常见金属晶体的晶胞结构(晶体内部空地的辨认、与晶胞的边长等晶体结构参数相关的核算不作要求).
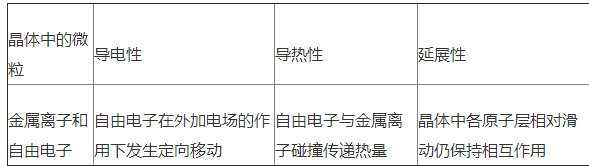
②金属键的强弱和金属晶体熔沸点的改变规则:阳离子所带电荷越多、半径越小,金属键越强,熔沸点越高.如熔点:NaMgAl,LiNaKRbCs.金属键的强弱能够用金属的原子
7.了解简略合作物的成键状况(合作物的空间构型和中心原子的杂化类型不作要求).
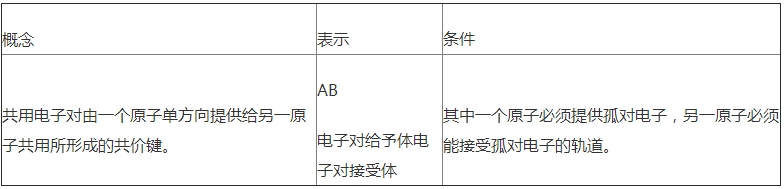
(1)配位键:一个原子供给一对电子与另一个承受电子的原子构成的共价键.即成键的两个原子一方供给孤对电子,一方供给空轨迹而构成的共价键.
(2)①.合作物:由供给孤电子对的配位体与承受孤电子对的中心原子(或离子)以配位键构成的化合物称合作物,又称络合物.
②构成条件:a.中心原子(或离子)有必要存在空轨迹.b.配位体具有供给孤电子对的原子.
④合作物的性质:合作物具有必定的安稳性.合作物中配位键越强,合作物越安稳.当作为中心原子的金属离子相一起,合作物的安稳性与配体的性质有关.
分子间作用力:把分子集合在一起的作用力.分子间作用力是一种静电作用,比化学键弱得多,包含范德华力和氢键.
2.知道分子晶体的意义,了解分子间作用力的巨细对物质某些物理性质的影响.
(1).分子晶体:分子间以分子间作用力(范德华力、氢键)相结合的晶体.典型的有冰、干冰.
(2).分子间作用力强弱和分子晶体熔沸点巨细的判别:组成和结构类似的物质,相对分子质量越大,分子间作用力越大,战胜分子间引力使物质熔化和气化就需求更加多的能量,熔、沸点越高.但存在氢键时分子晶体的熔沸点往往失常地高.
NH3、H2O、HF中因为存在氢键,使得它们的沸点比本家其它元素氢化物的沸点失常地高.
4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的差异.

扫描免费领近十年高考真题汇总备考、选科和专业解读重视高考网官方服务号
